ইলেক্ট্ৰন আৰু প্ৰট’ন কাক বোলে ? || পৰমাণুৰ উপ-পাৰমাণৱিক কণাকেইটা || পাৰমাণৱিক সংখ্যাক কিহৰে চোৱা হয়? || নিউট্ৰন কি ? || সম্ভ্ৰান্ত আৰু নিস্ক্ৰিয় গেছৰ মাজত পাৰ্থক্য || মৌলৰ পৰমাণুত থকা প্ৰ’টনৰ সংখ্যাক কি বোলে ? a- Particle কি হয়? || Electron -Proton- Neutron in Assamese
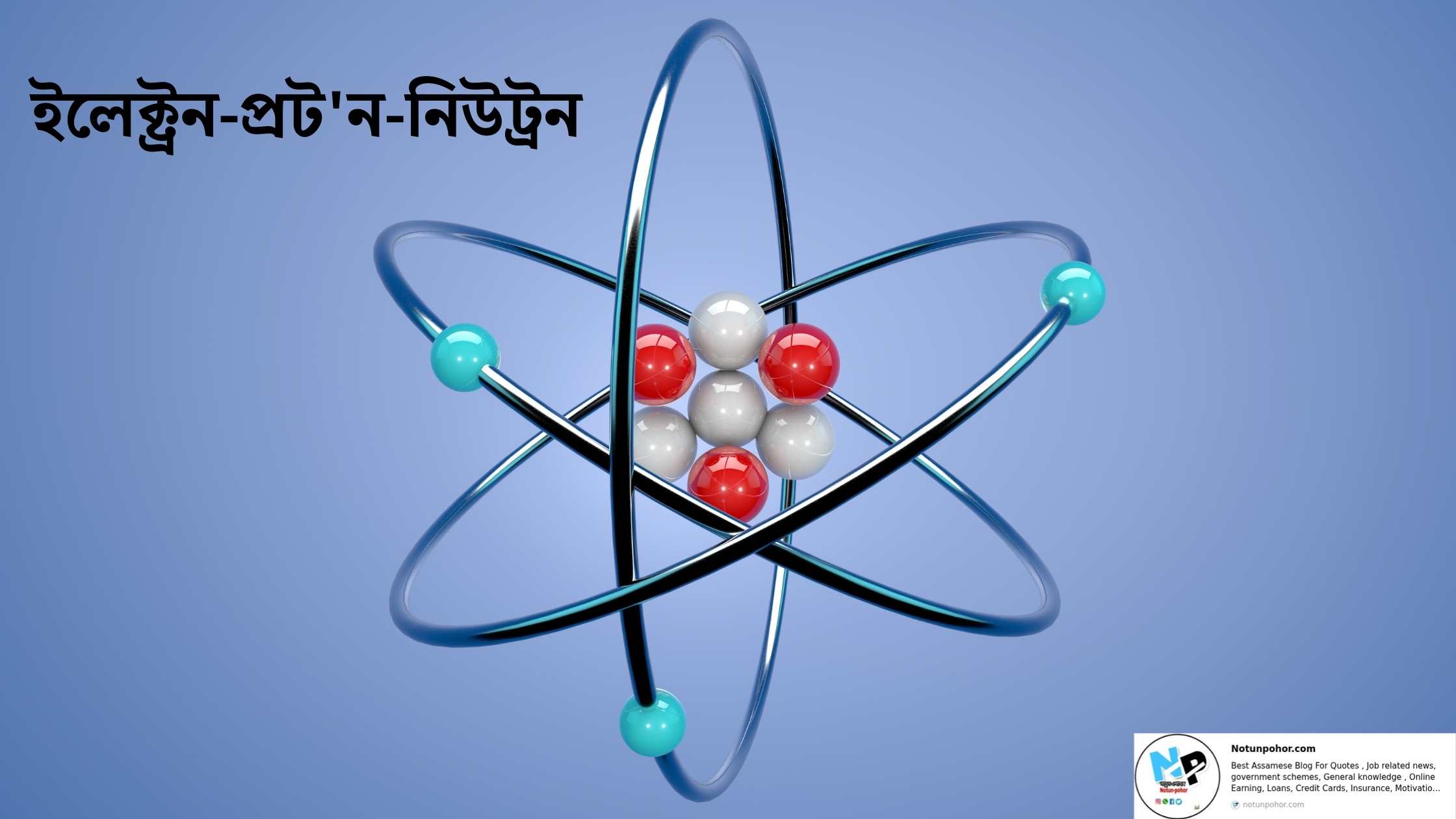
পৰমাণু –
ইলেক্ট্রন (Electron) :
যি উপ-পাৰমাণৱিক কণাই একক ঋণাত্মক আধান বহন কৰে আৰু যাৰ ভৰ হাইড্ৰ’জেন পৰমাণুৰ ভৰৰ 1/1837 অংশৰ সমান, তাকে ইলেক্ট্রন বুলি কোৱা হয় ৷
প্র’টন (Proton) :
যি উপ-পাৰমাণৱিক কণাই একক ধনাত্মক আধান বহন কৰে আৰু যাৰ ভৰ এটা হাইড্ৰ’জেনৰ পৰামাণুৰ ভৰৰ সৈতে সমান তাকে প্ৰ’টন বুলি কোৱা হয়।
নিউট্রন (Neutron) :
যি আধান বিহীন উপ পাৰমাণৱিক কণিকাৰ ভৰ এটা হাইড্ৰ’জেনৰ পৰমাণুৰ ভৰৰ সৈতে প্রায় সমান তাকে নিউট্রন হিচাপে সংজ্ঞাবদ্ধ কৰা হয় ৷
কেথড ৰশ্মি (Cathode rays) :
বিদ্যুত মোক্ষা নলী এটাত অতি কম চাপত বিদ্যুৎ পৰিবাহিত কৰিলে কেথডৰ পৰা এনডলৈ সেউজ নীলা ৰঙৰ কিছুমান ৰশ্মি সৰল ৰেখাত গতি কৰে।
সুৰংগ ৰশ্মি (Canal rays) :
ধনাত্মক আধানযুক্ত কণিকাৰ দ্বাৰা সুৰংগ ৰশ্মি গঠিত। এই কণিকাবোৰক প্ৰ’টন বুলি কোৱা হয়। সুৰংগ ৰশ্মিক এন’ড ৰশ্মি বা ধনাত্মক ৰশ্মি বুলিও কোৱা হয়।
পাৰমাণৱিক সংখ্যা (Atomic number) :
এটা মৌলৰ পৰমাণু এটাৰ নিউক্লিয়াছত থকা প্ৰ’টনৰ মুঠ সংখ্যাক সেই মৌলটোৰ পাৰমাণৱিক সংখ্যা বুলি কোৱা হয়। পাৰমাণৱিক সংখ্যাক Z ৰে চোৱা হয় ।
ভৰ সংখ্যা (Mass number) :
কোনো এটা মৌলৰ পৰমাণু এটাৰ নিউক্লিয়াছত থকা নিউট্ৰন আৰু প্ৰ’টনৰ মুঠ সংখ্যাক ভৰসংখ্যা বুলি কোৱা হয় ।
নিউক্লিয়ন (Nucleons) :
পৰামাণু এটাৰ নিউক্লিয়াছত থকা প্ৰ’টন আৰু নিউট্ৰনক একেলগে নিউক্লিয়ন বুলি কোৱা হয় ৷
সমস্থানিক (Isotope) :
একে পাৰমাণৱিক সংখ্যা বিশিষ্ট একেটা মৌলৰ বিভিন্ন ভৰসংখ্যা বিশিষ্ট পৰমাণুসমূহক মৌলটোৰ সমস্থানিক বোলা হয়।
সমভাৰী (Isobar) :
ভিন ভিন পাৰমাণৱিক সংখ্যা বিশিষ্ট, কিন্তু একে ভৰসংখ্যাৰ বিভিন্ন মৌলৰ পৰামাণুবোৰক সমভাৰী বুলি কোৱা হয় ।
a-কণিকা (a-Particle) :
দুই একক ধনাত্মক আধান বিশিষ্ট আৰু একক ভৰবিশিষ্ট হিলিয়াম পৰামাণুক (He2+) a – কণিকা বুলি জনা যায়।
নিউক্লিয়াছ (Nucleus) :
ই পৰমাণুৰ কেন্দ্ৰত অৱস্থিত প্ৰ’টন আৰু নিউট্রন বিশিষ্ট এক ক্ষুদ্র অঞ্চল।
কক্ষপথ (Orbits) :
পৰমাণু এটাত থকা ইলেক্ট্ৰনবোৰে কিছুমান নিৰ্দিষ্ট নির্বাচিত বৃত্তাকাৰ পথেৰে নিউক্লিয়াছৰ চাৰিওফালে ঘূৰি থাকে। এই পথসমূহক কক্ষপথ বুলি কোৱা হয়।
শক্তিস্তৰ বা শক্তি কক্ষ (Energy levels or energy shells) :
এটা নিৰ্দিষ্ট কক্ষপথত থকালৈকে ইলেক্ট্র’ন এটাই শক্তি আহৰণ নকৰে বা 01 শক্তি নেহেৰুৱায়। আন কথাত এটা নিৰ্দিষ্ট কক্ষপথত এটা ইলেক্ট্ৰনৰ শক্তি স্থিৰ হৈ থাকে। সেইবাবে এই কক্ষপথবোৰক শক্তিস্তৰ বা শক্তি কক্ষ বোলে।
ইলেক্ট্রনীয় বিন্যাস (Electronic configuration):
মৌলৰ পৰমাণুএটাৰ বিভিন্ন কক্ষপথত থকা ইলেক্ট্ৰনৰ সজ্জাক মৌলটোৰ ইলেক্ট্ৰনীয় সজ্জা হিচাপে জনাযায়। নিৰ্দিষ্ট নিয়ম অনুসৰি শক্তিস্তৰবোৰৰ মাজত ইলেক্ট্ৰনবোৰ সজ্জিত হৈ থাকে।
সম্ভ্রান্ত গেছ (Noble gas) :
কিছুমান মৌলৰ বহিৰতম কক্ষ সম্পূৰ্ণৰূপে পূৰ হৈ থাকে। এই মৌলবোৰক সম্ভ্রান্ত গেছ বুলি কোৱা হয়। বহিৰতম কক্ষ সম্পূৰ্ণৰূপে পূৰ হৈ থকা বাবে ইয়াত যোজক ইলেক্ট্রন নাথাকে। ফলস্বৰূপে, সম্ভ্রান্ত গেছবোৰে পৰস্পৰৰ লগত অথবা, আন মৌলৰ পৰমাণুৰ লগত সাধাৰণ অৱস্থাত বিক্ৰিয়া কৰি যৌগ গঠন নকৰে। ইহঁতবোৰ ৰাসায়নিক ভাৱে নিস্ক্ৰিয় আৰু সেয়ে ইহঁতক নিস্ক্রিয় গেছ বুলিও কোৱা হয়। সম্ভ্রান্ত গেছে সদায় পাৰমাণৱিক অৱস্থাত বৰ্তি থাকে।
অষ্টক নিয়ম (Octet rule) :
ৰাসায়নিক বান্ধনি গঠন কৰোঁতে প্ৰতিটো পৰমাণুৱে বহিৰ্তম কক্ষত আঠটা ইলেক্ট্ৰন গ্ৰহণ কৰি ওচৰৰ সম্ভ্ৰান্ত গেছৰ সুস্থিৰ ইলেক্ট্র নীয় বিন্যাস লাভ কৰিব বিচাৰে ।
যোজ্যতা (Valency) :
কোনো এটা ৰাসায়নিক বিক্ৰিয়াত এটা পৰমাণুৱে ইয়াৰ নিকটতম সম্ভ্ৰান্ত গেছৰ ইলেক্ট্র’নীয় সজ্জা পাবলৈ যিমান সংখ্যক ইলেক্ট্রন ত্যাগ কৰে বা গ্ৰহণ কৰে বা অন্য পৰমাণুৰ সৈতে ভাগ কৰে সেই সংখ্যাটোকে মৌলটোৰ যোজ্যতা (ইলেক্ট্ৰ’নীয় বিন্যাসৰ আধাৰত) বোলা হয়।
যোজক ইলেক্ট্রন (Valence electrons) :
পৰমাণু এটাৰ বহিৰতম কক্ষটোৰ ইলেক্ট্রনবোৰক যোজক ইলেক্ট্র’ন বোলা হয়। কেৱল যোজক ইলেক্ট্ৰ’নবোৰেহে ৰাসায়নিক বিক্ৰিয়াত অংশগ্রহণ কৰিব পাৰে ।